引言
竞争性抑制剂与底物可逆地结合在同一位点上,因此只要使用极高浓度的底物,就能完全克服其抑制作用。Vmax 不会改变,而有效 Km 会增加。您可以通过测量几种浓度的抑制剂存在时的底物-速度曲线来确定竞争性抑制剂的 Ki。
步骤如下
创建 XY 数据表。在 X 列输入底物浓度,在 Y 列输入酶活性。每个数据集(Y 列)代表在存在不同浓度抑制剂(从零浓度开始)时收集的数据。在列标题中输入这些浓度。请务必输入浓度,而不是浓度的对数。
或者选择竞争性酶抑制样本数据集。
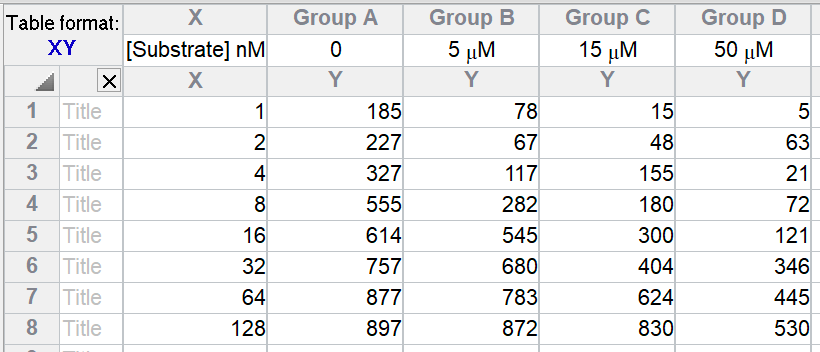
输入数据后,单击分析,选择非线性回归,选择酶动力学方程面板,然后选择竞争性酶 抑制。
模型为
KmObs=Km*(1+[I]/Ki)
Y=Vmax*X/(KmObs+X)
常数I是抑制剂的浓度,是您在每列标题中输入的值。该值受限于等于数据集常数。
参数Vmax、Km和Ki是共享的,因此 Prism 为整个数据集拟合了一个最佳控制数据值。
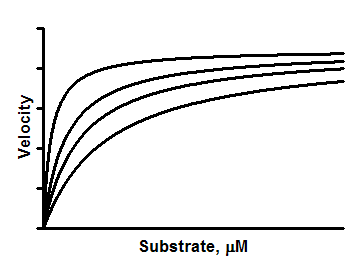
解读参数
Ki 是 抑制常数,用与 I 相同的单位表示,您将其输入列标题。
Vmax是无抑制剂时的最大酶速,单位与 Y 相同。
Km 是Michaelis-Menten 常数,单位与 X 相同,用于描述底物与酶在无抑制剂情况下的交互作用。
如果数据不能很好地拟合模型,可考虑改用非竞争性 或非竞争性模型。或者拟合到混合模型抑制的更通用方程。
参考文献
公式 3.1RA Copeland,Evaluation of Enzyme Inhibitors in Drug Discovery,Wiley 2005。IBSN:0471686964.RA Copeland, Evaluationof Enzyme Inhibitors in Drug Discovery, Wiley 2005.IBSN:0471686964.