Introduction
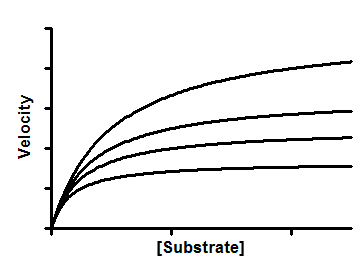
An uncompetitive inhibitor binds to the enzyme-substrate complex, but not the free enzyme. This reduces both the effective Vmax and the effective Km. The substrate-velocity curve is shifted down and to the left.
You can determine the Ki of a competitive inhibitor by measuring substrate-velocity curves in the presence of several concentrations of inhibitor.
Step by step
Create an XY data table. Enter substrate concentration into the X column, and enzyme activity into the Y columns. Each data set (Y column) represents data collected in the presence of a different concentration of inhibitor, starting at zero. Enter these concentrations into the column titles. Be sure to enter concentrations, not logarithms of concentration.
After entering data, click Analyze, choose nonlinear regression, choose the panel of enzyme kinetics equations, and choose Uncompetitive enzyme inhibition.
The model
VmaxApp=Vmax/(1+I/AlphaKi)
KmApp=Km/(1+I/AlphaKi)
Y=VmaxApp*X/(Kmapp+X)
The constant I is the concentration of inhibitor, a value you enter into each column title. This is constrained to equal a data set constant.
The parameters Vmax, Km and Ki are shared, so Prism fits one best-fit value for the entire set of data.
Interpreting the parameters
Vmax is the maximum enzyme velocity absence of inhibitor, expressed in the same units as Y.
Km is the Michaelis-Menten constant (absence of inhibitor), expressed in the same units as X. It describes the interaction of substrate and enzyme in the absence of inhibitor.
AlphaKi is the inhibition constant, expressed in the same units as I, which you entered into the column titles. It is the product of Ki (which is very high, because uncompetitive inhibitors don't bind to the enzyme) and alpha (which is very low). It is not possible to fit alpha and Ki separately, but only to determine their product. Some books call this product Ki'.
If the data don't fit the model well, consider instead fitting to a competitive or noncompetitive model. Or fit to the more general equation for mixed-model inhibition.
Reference
Equation 3.6 in: RA Copeland, Evaluation of Enzyme Inhibitors in Drug Discovery, Wiley 2005. IBSN:0471686964.RA Copeland, Evaluation of Enzyme Inhibitors in Drug Discovery, Wiley 2005. IBSN:0471686964.